最新上市的抗癌新药是什么
*** 次数:1999998 已用完,请联系开发者***

临床结果未达预期 天士力暂停抗癌新药八年研发“长跑”|速读公告财联社11月22日讯(记者 武超)由于临床结果未达预期、且市场竞争日趋激烈,天士力(600535.SH)宣布暂停旗下一款已经历八年的研发与相应临床试验的抗癌药物。该研发项目还有赛伦生物(688163.SH)参股,两家上市公司预计为此分别计提资产减值损失1.62亿元、1414.48万元。 据悉,本...
辉瑞(PFE.US)抗癌新药“阿昔替尼”新适应症在中国申报上市8月16日,中国国家药监局药品审评中心(CDE)官网公示,辉瑞(Pfizer /PFE.US)申报的阿昔替尼片新适应症上市申请获得受理,具体适应症尚无披露。公开资料显示,阿昔替尼(axitinib)是一款能够抑制VEGFR1-3活性的酪氨酸激酶抑制剂(TKI),此前已在中国获批用于治疗肾细胞癌。
˙▂˙ 靶向药仍是新药研发热点,本月10款创新药中4款是抗癌药(人民日报健康客户端记者 孔天骄)据人民日报健康客户端不完全统计,5月已有10款新药获得国家药品监督管理局(NMPA)批准上市。在这些创新药中,有4款是靶向抗癌药。这4款靶向抗癌药主要是获批用于不同类型的肺癌患者群体的治疗。包括5月24日获批上市的康方生物的双靶向抗体...

o(?""?o 石药集团:向美国FDA提交伊立替康脂质体注射液之新药上市申请石药集团12月18日在港交所公告,集团已向美国食品药品监督管理局提交用于治疗接受吉西他滨治疗后进展的转移性胰腺癌患者的伊立替康脂质体注射液的新药上市申请。此为集团首次于美国提交复杂脂质体包里抗癌化疗的新药上市申请。本文源自金融界AI电报
石药集团(01093)向美国FDA提交伊立替康脂质体注射液的新药上市申请智通财经APP讯,石药集团(01093)发布公告,该集团已向美国食品药品监督管理局(FDA)提交用于治疗接受吉西他滨治疗后进展的转移性胰腺癌患者的伊立替康脂质体注射液(该产品)的新药上市申请(NDA)。此为集团首次于美国提交复杂脂质体包裹抗癌化疗的新药上市申请。根据世界卫...

石药集团(01093.HK)向美国FDA提交伊立替康脂质体注射液新药上市...【财华社讯】石药集团(01093.HK)公布,集团已向美国食品药品监督管理局(FDA)提交用于治疗接受吉西他滨治疗后进展的转移性胰腺癌患者的伊立替康脂质体注射液的新药上市申请(NDA)。此为集团首次于美国提交复杂脂质体包裹抗癌化疗的新药上市申请。本次的NDA提交乃基于开发...
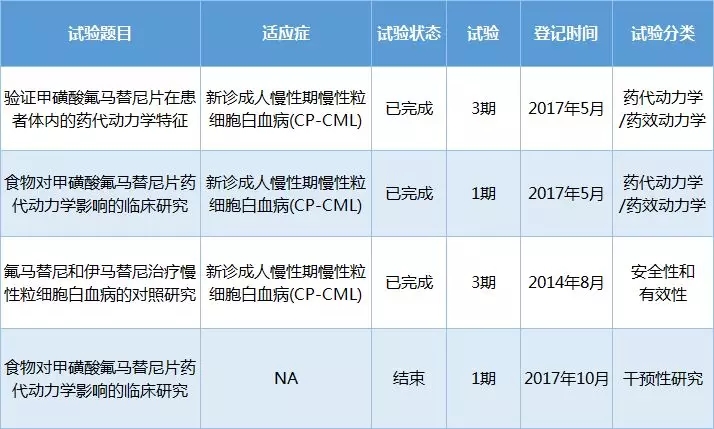
石药集团(01093.HK)向美国FDA提交伊立替康脂质体注射液的新药上市...石药集团(01093.HK)发布公告,该集团已向美国食品药品监督管理局(FDA)提交用于治疗接受吉西他滨治疗后进展的转移性胰腺癌患者的伊立替康脂质体注射液(该产品)的新药上市申请(NDA)。此为集团首次于美国提交复杂脂质体包裹抗癌化疗的新药上市申请。本文源自金融界AI电报
●^● 迈威生物:注射用8MW0511新药上市申请获得受理迈威生物公告,近日,公司全资子公司江苏泰康生物医药有限公司收到国家药品监督管理局核准签发的《受理通知书》,注射用8MW0511的新药上市申请获得受理,用于成年非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,使用本品降低以发热性中...
ˇ0ˇ 
迈威生物(688062.SH):注射用8MW0511新药上市申请获受理智通财经APP讯,迈威生物(688062.SH)发布公告,近日,公司全资子公司江苏泰康生物医药有限公司收到国家药品监督管理局核准签发的《受理通知书》,注射用8MW0511的新药上市申请获得受理,用于成年非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药...

21CC肿瘤情报(第70期):GSK抗癌药物Omjjara在欧盟获批上市;百泰...21CC(cancer care),我们关注与癌症相关的一切!21世纪新健康研究院创新资讯栏目——21CC肿瘤情报,梳理一周肿瘤资讯,全面聚焦癌症防治,早发现早诊断早治疗,与君健康同行。一、新药(新适应症/技术)获批GSK抗癌药物Omjjara在欧盟获批上市1月29日,葛兰素史克表示,欧盟委员会批...

789加速器部分文章、数据、图片来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知删除。邮箱:xxxxxxx@qq.com
上一篇:最新上市的抗癌新药是什么
下一篇:极光加速器官方





